|
MADDE VE
ÖZELLİKLERİ
Kütlesi ve hacmi olan tüm varlıklara madde denir.
Kalem, silgi, taş, toprak, hava gibi tüm varlıklar madde tanımına
girerler.
Kütle:
Bir cismin sahip olduğu değişmez madde miktarıdır. Yani bir taş
parçasını Dünyada da tartsak Ay'da da tartsak kütlesi değişmeyen sabit
bir değerdir.
Hacim:
Bir cismin kapladığı yerdir.
MADDENİN ÖZELLİKLERİ
Maddenin iki tür özelliği vardır:
1.
Ortak özellikler:
Farklı maddelerin aynı olabilecek özellikleridir. Kütle,
hacim, eylemsizlik, boşluklu yapı gibi.
2.
Ayırt Edici Özellikler:
Aynı şartlarda
ölçüldüğünde farklı maddeler için farklı değerler alan özelliklerdir.
Özkütle, erime, kaynama noktası gibi.
ORTAK ÖZELLİKLER AYIRT EDİCİ
ÖZELLİKLER
|
1. Kütle
2. Hacim
3. Eylemsizlik
4. Boşluklu yapı |
1
. Özkütle
2. Erime noktası
3. Kaynama noktası
4. Çözünürlük
5. Esneklik
6. Genleşme v.b |
ORTAK ÖZELLİKLER
Ortak özellikler maddenin miktarına bağlı özelliklerdir.
Madde miktarı arttığında yada azaldığında ortak özelliklerin diğerleri
de artar ya da azalır.
AYIRT EDİCİ ÖZELLİKLER
Ayırt edici özellikler madde miktarına bağlı olmayan
özelliklerdir.
Ayırt edici özellikler farklı maddeler için aynı şartlarda ölçüldüğünde
farklı değerlerdir.
|
|

Özelliğin
Maddenin Üç Hali İçin Ayırt Edici Olup Olmadığı
|
|
Ayırt Edici Özellik |
Katı |
Sıvı |
Gaz |
|
Özkütle (Yoğunluk) |
+ |
+ |
+ |
|
Çözünürlük |
+ |
+ |
+ |
|
Genleşme |
+ |
+ |
- |
|
Erime Noktası |
+ |
- |
- |
|
Kaynama Noktası |
- |
+ |
- |
|
İletkenlik |
+ |
+ |
- |
|
Esneklik |
+ |
- |
- |
AMETALLER
1.
Katı-sıvı ve gaz halde bulunabilirler
2.
Tel ve levha haline getirilemezler
3.
Isı ve elektriği iletmezler (Karbon hariç)
4.
Bileşiklerinde hem pozitif hem de negatif değerlik alabilirler ancak
negatif (-) değerliği tercih eder.
5.
Ametaller hem kendi aralarındı hem de metallerle bileşik oluşturan
6.
Kendi aralarında kovalent yapılı; metallerle iyonik yapılı bileşikler
oluştururlar.
7.
Oksijenle oluşturdukları bileşikte suda çözününce asit özelliği gösterir.
8.
Canlı organizmaların yapısında çokça bulunurlar. En çok bulunanları karbon
(C) ve hidrojen (H) dir.
Metaller:
Demir: Fe Bakır: Cu Çinko: Zn Kalsiyum: Ca Magnezyum: Mg Sodyum:
Na
Ametaller:
Hidrojen:H Azot: N Kükürt: S
Saf maddelerden olan
bileşiklerin özelliklerini inceleyelim:
Bileşik:
Farklı cins elementlerin
kendi özelliklerini kaybederek belirli oranlarda birleşmesi ile oluşan
yeni özellikteki saf maddelere bileşik adı verilir.
Molekül:Bileşiklerin
tüm özelliklerini taşıyan en küçük birimdir.
Moleküller ikiye ayrılır.
Element Molekülü:
Aynı cins elementlerin bir
araya gelmesi ile oluşan moleküllerdir. 02 , N2 , F2
, gibi
Bileşik Molekülü:
Farklı tür element
atomlarının bir araya gelmesi ile oluşan moleküllerdir. H20 ,
C02 , CO, N205 gibi
Bileşik molekülleri elektroliz gibi kimyasal yöntemlerle kendilerini
oluşturan elementlere ayrıştırabilirler.
Su (H2
O) hepimizin çok iyi bildiği bir bileşik çeşididir. Suyun özellikleri
yardımı ile bileşiklerin genel özelliklerinin neler olduğunu aşağıdaki
tablo yardımı ile kavramaya çalışalım:
|
ÖRNEK BİLEŞİĞİN ÖZELLİKLERİ(Su) |
BİLEŞİKLERİN GENEL ÖZELLİKLERİ |
|
1. Hidrojen ve oksijen
gibi iki elementten (saf maddeden) oluşmuştur. |
1 . Saf ve
homojendirler. |
|
2. Su, daima 2
hidrojen, 1 oksijen atomundan oluşur. |
2. Bileşiği oluşturan
elementlerin atom ve kütlece birleşme oranlan sabittir. |
|
3. Hidrojen yanıcı
oksijen yakıcı olduğu halde su bu iki özelliği taşımaz, aksine
söndürücü olarak kullanılır. |
3. Kendini oluşturan
elementlerin özelliklerini taşımazlar. |
|
4. Suyun en küçük
birimi 2H ve 1 oksijenden oluşan su (H2 O) molekülüdür. |
4. En küçük yapı
taşları moleküllerdir ve molekül formülü ile gösterilirler. |
|
5. Su normal şartlarda
daima 0°C de donar, 100°C de kaynar. |
5. Belirli erime ve
kaynama noktaları vardır. Kristal olmayanlar hariç |
|
6. Su kaynatıldığında
elementlerine ayrışmaz ancak elektrolizle elementlerine ayrışır. |
6. Fiziksel yollarla
bileşenlerine ayrışmazlar, ancak kimyasal yollarla bileşenlerine
ayrışırlar. |
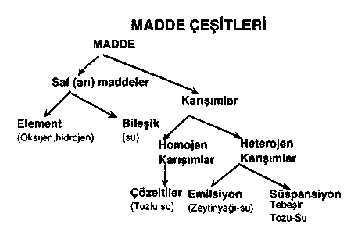
KARIŞIMLARIN ÖZELLİKLERİ
|
ÖRNEK KARIŞIMIN
ÖZELLİKLERİ(Şekerli Su) |
KARIŞIMLARIN GENEL
ÖZELLİKLERİ |
|
1. Şekerli su,
karışımlardan hem suyun hem de şekerin özelliklerini taşır. |
1. Karışımı oluşturan
saf maddelerin özelliklerini taşırlar. |
|
2. Şekerli su hazırlanırken istenen oranlarda şeker ve su birbirine
karıştırılabilir |
2. Karışımı oluşturan maddeler istenen oranlarda karıştırılabilirler. |
|
3. Şekerli su, saf su gibi 0°C de donup, 100°C de kaynamaz |
3. Karışımların saf maddeler gibi belli erime ve kaynama noktaları
yoktur. |
|
4. Şekeri suyun suyunu buharlaştırılırsak geriye saf olarak şeker
kalır. |
4. Fiziksel yöntemlerle karışanlarına ayrıştırıla bilirler. |
|
5. Şekerli su içerisinde hem şeker molekülleri hem de su molekülleri
karışım halindedir. |
5. Farklı cinsten atom ya da moleküller içerirler. |
|
6. Şekerli su karışımı homojen, tebeşir su karışımı ise heterojendir. |
6. Karışımlar homojen ve heterojen olabilirler. |
BİLEŞİK VE
KARIŞIMLAR ARASINDAKİ FARKLAR
|
BİLEŞİKLERİN
ÖZELLİKLERİ |
KARIŞIMLARIN
ÖZELLİKLERİ |
|
1. Bileşiği oluşturan elementler belirli oranlarda birleşirler. |
1. Karışımı oluşturan maddeler istenen oranlarda karıştırılabilirler. |
|
2. Saf ve homojendirler. |
2. Saf değillerdir. Homojen ve heterojen olabilirler. |
|
3. Erime ve kaynama noktaları sabittir |
3. Erime ve kaynama noktaları sabit değildir. |
|
4. Kimyasal yöntemlerle elementlerine ayrışırlar. |
4. Fiziksel yöntemlerle karışanlarını ayrılırlar. |
|
5. Belirli formülleri vardır. |
5. Formülleri yoktur. |
|
6. Bileşiği oluşturan elementler bileşik içinde özelliklerini
kaybederler. |
6. Karışanlar özelliklerini karışım içerisinde de korurlar |
| 







